Distribuidores
Encontre aqui informação relevante para os titulares de autorizações de distribuição por grosso de medicamentos de uso humano.
Verificação de autenticidade da embalagem e desativação do Identificador Único
No Regulamento Delegado (EU) n.º 2016/161, da Comissão de 2 de Outubro de 2015 é estabelecido que os distribuidores (e.g. pré-grossistas, grossistas, armazenistas) devem executar as operações de verificação e/ou desativação das embalagens que estejam na sua posse.
O sistema europeu de verificação de medicamentos não foi concebido numa lógica de track & trace. Tal significa que a obrigatoriedade de execução das operações de verificação de autenticidade e desativação do identificador único é aplicável em determinadas circunstâncias. Assim, as operações de verificação e desativação do identificador único por distribuidores são obrigatórias nos seguintes casos (conforme o Artigo 22º do Regulamento Delegado):
- Medicamentos que ele tenciona distribuir fora da União;
- Medicamentos que lhe tenham sido devolvidos por pessoas autorizadas ou habilitadas a fornecer medicamentos ao público ou por outro grossista;
e que não podem ser restituídos às existências comerciáveis; - Medicamentos que se destinam a ser destruídos;
- Medicamentos que, apesar de estarem na sua posse física, são solicitados como amostra pelas autoridades competentes;
- Medicamentos a distribuir às pessoas ou instituições referidas no artigo 23º do Regulamento, quando exigido pela legislação nacional em conformidade com o mesmo artigo. O Decreto-Lei nº26/2018, de 24 de Abril estabelece no número 9 do artigo 105º-A que os distribuidores deverão executar as operações de verificação de autenticidade e desativação das embalagens a distribuir a “Locais de venda de medicamentos não sujeitos a receita médica”, e a “estabelecimentos e serviços detentores de autorização de aquisição direta de medicamentos emitida pelo INFARMED, I. P., que não estejam integrados em estabelecimentos de cuidados de saúde, públicos ou privados, que disponham de serviços médicos e farmacêuticos e regime de internamento”.
De acordo com o Regulamento Delegado (conforme o artigo 20º), os distribuidores são ainda obrigados a executar as operações de verificação de autenticidade do identificador único dos medicamentos que medicamentos que lhe são devolvidos por pessoas autorizadas ou habilitadas a fornecer medicamentos ao público ou por outro grossista, e dos medicamentos que recebe de um grossista que não é nem o fabricante nem o grossista titular da autorização de introdução no mercado, nem um grossista designado pelo titular da autorização de introdução no mercado, através de um contrato escrito, para armazenar e distribuir em seu nome os medicamentos abrangidos pela sua autorização de introdução no mercado.
De acordo com o Regulamento Delegado (conforme o artigo 21º), não é exigida aos distribuidores a verificação da autenticidade do identificador único quando:
- O medicamento em causa muda de proprietário, mas permanece na posse física do mesmo grossista;
- O medicamento em causa é distribuído no território de um Estado-Membro entre dois entrepostos pertencentes ao mesmo grossista ou à mesma entidade legal e não se verifica qualquer venda.
As obrigações dos distribuidores estão descritas nos capítulos III e V do Regulamento Delegado.
Acesso ao sistema de verificação de medicamentos
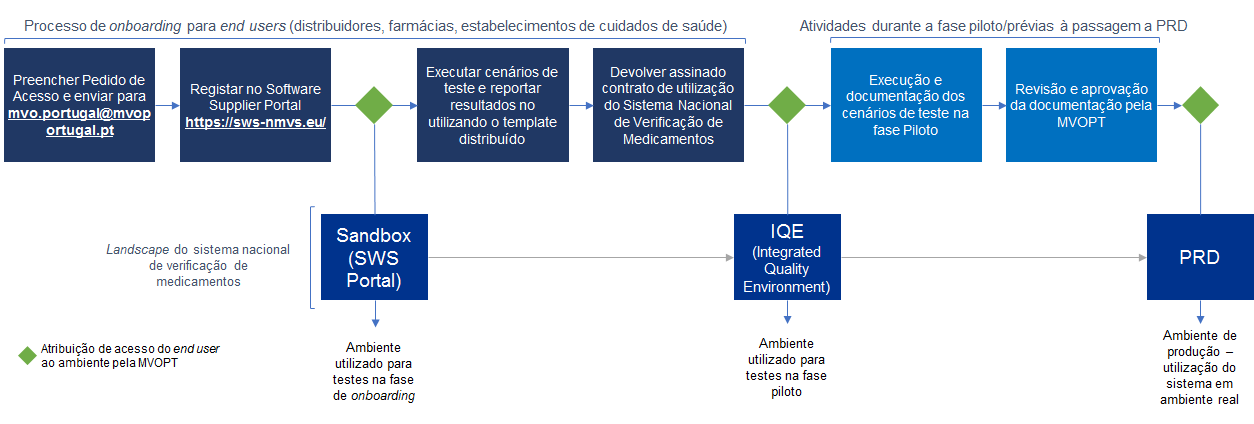
Para que um determinado utilizador possa aceder ao sistema nacional de verificação de medicamentos, deverá ser concluído com sucesso o processo de validação de acesso. Este processo é designado por processo de onboarding e tem como objetivos a validação da legitimidade do acesso ao sistema, a validação técnica e a assinatura do contrato que regulará a relação entre cada entidade e a MVO Portugal.
O processo de onboarding é composto pelos seguintes passos:
- Preenchimento e envio do formulário de pedido de acesso. Uma vez preenchido, o formulário deverá ser remetido para o endereço de email mvo.portugal@mvoportugal.pt.
- Registo no portal https://sws-nmvs.eu/. Neste portal está disponível a documentação técnica (i.e. exemplos de código, descrição dos interfaces, etc.) necessária ao desenvolvimento das integrações com o sistema nacional de verificação de medicamentos;
- Execução dos testes preliminares. Os testes preliminares são executados após registo com sucesso no portal referido no ponto anterior, utilizando a funcionalidade baseline testing. Os testes são executados no ambiente sandbox e os resultados dos testes devem ser documentados no formulário disponibilizado pela MVO Portugal;
- Assinatura da minuta contratual. A minuta contratual será enviada por email após receção do formulário de pedido de acesso. Deverão ser assinados dois exemplares, que deverão ser remetidos para a seguinte morada:
MVO Portugal – Associação Portuguesa de Verificação de Medicamentos
Edificio ATLAS I,
Após boa receção e validação, será devolvido um dos exemplares assinado pela MVO Portugal.
Av. José Gomes Ferreira, nº 9, 4º
1495-139 Miraflores, Algés
Uma vez concluídos com sucesso os quatro passos descritos acima, serão concedidas as credenciais de acesso ao ambiente de testes do sistema nacional de verificação de medicamentos.
Uma vez tendo sido atribuídas as credenciais de acesso ao ambiente de testes, designado por IQE (ver esquema abaixo), deverão ser executados testes adicionais, prévios à passagem para o ambiente de produção. Os testes a executar estão descritos e deverão ser documentados segundo a documentação disponibilizada pela MVO Portugal.
Uma vez concluídos e validados pela MVO Portugal os passos no ambiente de testes descritos acima, são atribuídas as credenciais de acesso ao ambiente de produção e o processo é finalizado.
Esquematicamente: